suivant: Croissance d'une chaîne constituée monter: Description du modèle électronique précédent: Les liaisons fortes Table des matières
Si nous avons deux types d'atomes, nous obtenons le même type d'équation en suivant
le même raisonnement avec deux énergies pour les électrons de valence
liés aux atomes, soit
![]() ou
ou
![]() selon que l'atome situé à la position j est un atome A ou B.
De plus, nous aurons trois intégrales de saut que nous supposerons ici
identiques
selon que l'atome situé à la position j est un atome A ou B.
De plus, nous aurons trois intégrales de saut que nous supposerons ici
identiques
![]() afin de simplifier notre modèle.
Cette approximation consiste à supposer qu'un électron a la même
probabilité de sauter d'un atome à l'autre quel que soit l'atome sur lequel
il se trouve.
Notre équation matricielle deviendra alors:
afin de simplifier notre modèle.
Cette approximation consiste à supposer qu'un électron a la même
probabilité de sauter d'un atome à l'autre quel que soit l'atome sur lequel
il se trouve.
Notre équation matricielle deviendra alors:
| (3.8) |
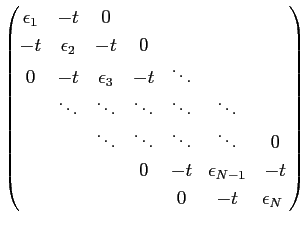 |
(3.9) |
Par exemple pour une molécule AB, nous aurons les valeurs propres qui
satisfont à:
![\includegraphics[scale=0.72,clip=false]{linear/2niveau.eps}](img269.png) |