suivant: Comparaison des sections efficaces monter: Comparaison avec les résultats précédent: Comparaison avec les résultats Table des matières
Après un long développement mathématique et
numérique, il nous faut vérifier que nos simulations sont en accord avec
ce que nous dit la nature.
Pour ce faire, il nous faut réaliser des expériences numériques sur lesquelles
nous disposons de données expérimentales à comparer.
Dans un premier temps, il est possible de voir la géométrie des molécules
formées dans le minimum d'énergie potentielle.
Pour la molécule d'hydrogène, nous trouvons une distance inter-atomique de 0.070 nm
avec la méthode PM3, ce qui est en accord avec les données spectroscopiques de prédiction
de distance inter-atomique de 0.07416 nm [58].
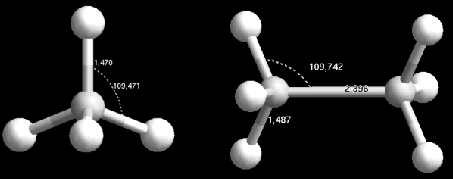
Il en est de même pour la géométrie de ![]() et de
et de ![]() qui possèdent des longueurs
et angles en accord avec les données spectroscopiques.
(par exemple, par la spectroscopie : liaison
qui possèdent des longueurs
et angles en accord avec les données spectroscopiques.
(par exemple, par la spectroscopie : liaison ![]() = 0.148111(6) nm pour
= 0.148111(6) nm pour ![]() alors
que nous trouvons 0.147 nm par la simulation (Fig 4.4).)
Les erreurs obtenues sont de quelques pourcents ce qui est très acceptable
étant donné les approximations drastiques que nous avons faites pour diminuer le
temps de calcul.
alors
que nous trouvons 0.147 nm par la simulation (Fig 4.4).)
Les erreurs obtenues sont de quelques pourcents ce qui est très acceptable
étant donné les approximations drastiques que nous avons faites pour diminuer le
temps de calcul.
|
De cette façon, la vérification des données géométriques nous renseigne sur l'exactitude des minima d'énergie potentielle calculés. Cependant, le point d'équilibre n'est pas le seul paramètre important des courbes de potentiel puisque la totalité de la courbe intervient lors de la réaction chimique. Ainsi, il faut réaliser d'autres expériences numériques afin de vérifier l'exactitude des courbes de potentiel quelque soit la distance entres les atomes. Il faut donc effectuer une comparaison des simulations avec des données expérimentales disponibles qui mettent en jeu des interactions entres atomes pour un ensemble de distances inter-atomiques. Un exemple qui prend en compte ces exigences peut être trouvé dans les courbes expérimentales de sections efficaces.